O-결합 글리코실화
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
O-결합 글리코실화는 당이 단백질의 세린 또는 트레오닌 잔기에 결합하는 공유 결합 변형으로, 다양한 생물학적 과정에 관여한다. O-GalNAc, O-GlcNAc, O-만노스, O-갈락토스, O-푸코스, O-글루코스와 같은 여러 유형이 있으며, 각 유형은 다른 효소와 기질을 사용한다. O-GalNAc 글리코실화는 가장 흔하며, 뮤신과 같은 단백질의 기능에 중요하다. O-GlcNAc 글리코실화는 세포질 및 핵 단백질에서 가역적으로 일어난다. O-만노스 글리코실화는 뇌와 근육 조직에서 주로 발견되며, α-디스트로글리칸의 기능에 필수적이다. O-갈락토스 글리코실화는 콜라겐의 수산화라이신 잔기에 일어나며, O-푸코스 글리코실화는 노치 단백질과 같은 단백질의 EGF 도메인에서 발견된다. 프로테오글리칸은 O-결합 글리코실화를 통해 GAG를 포함하며, 세포 표면과 세포 외 기질에서 중요한 역할을 한다. O-결합 글리코실화는 지질의 글리코스핑고지질을 형성하는 데에도 관여하며, 글리코제닌에서 글리코겐 합성에 기여한다. O-결합 글리코실화의 변화는 혈액형, 면역글로불린 기능, 알츠하이머병, 암 등 다양한 질병과 관련이 있다.
더 읽어볼만한 페이지
- 번역 후 변형 - 단백질 카보닐화
- 번역 후 변형 - 메틸화
메틸화는 메틸기를 분자에 첨가하는 과정으로, 생물학에서 유전자 발현 조절 등 생명현상에 관여하고 유기화학에서 유기 합성에 활용되며, 다양한 생물종에 존재하는 중요한 생리적 과정이다. - 생화학 - 부패
부패는 미생물에 의한 유기체의 사후 분해 과정으로, 악취 물질 생성, 시신 외형 변화를 동반하며 환경적·내적 요인에 따라 속도가 달라지고 법의학 등에서 연구된다. - 생화학 - 광합성
광합성은 생물이 빛에너지를 이용하여 이산화탄소와 물로부터 유기물을 합성하고 산소를 방출하는 과정으로, 엽록체 내 틸라코이드 막에서 일어나는 명반응과 스트로마에서 일어나는 암반응으로 구성되며, 환경에 따라 탄소 농축 메커니즘을 통해 효율을 높이기도 하고, 지구 대기의 산소를 생성하는 주요 원천이다.
2. O-글리코실화의 종류
O-글리코실화는 결합하는 당 분자의 종류에 따라 다양한 형태로 나뉜다. 가장 흔한 형태는 N-아세틸갈락토사민(GalNAc)이 세린 또는 트레오닌 잔기에 결합하는 O-GalNAc 글리코실화이다. 이 외에도 O-GlcNAc 글리코실화, O-만노스 글리코실화, O-갈락토스 글리코실화, O-푸코스 글리코실화, O-글루코스 글리코실화 등이 있다.
O-GalNAc 글리코실화는 단백질이 접힌 후 골지체에서 일어나며, GalNAc 전이효소(GALNT)에 의해 수행된다.[3][6] 초기 O-GalNAc 구조는 다른 당 (갈락토스, N-아세틸글루코사민, 푸코스, 시알산 등)이나 메틸기, 아세틸기 등의 화합물 첨가로 수정될 수 있다.[3] 이러한 변형은 현재까지 8개의 코어 구조를 생성한다.[2] 세포마다 다른 글리코실전이효소를 가지므로, O-글리칸 구조는 세포마다 다를 수 있다.[6]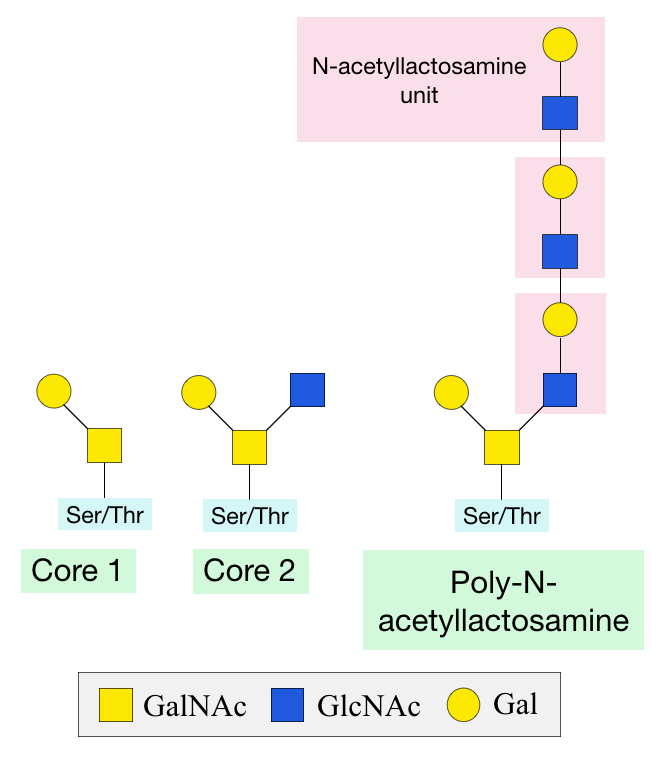
2. 1. O-GalNAc 글리코실화
O-GalNAc 글리코실화는 N-아세틸갈락토사민(GalNAc)이 단백질의 세린 또는 트레오닌 잔기에 결합하는 O-글리코실화의 가장 흔한 유형이다. 이 과정은 단백질이 접힌 후 골지체에서 일어나며, GalNAc 전이효소(GALNT)라는 효소에 의해 수행된다.[3][6]
2. 1. 1. 생합성
N-아세틸갈락토사민(GalNAc)의 첨가는 단백질 폴딩 후 골지체에서 일어나며,[3][6] GalNAc 전이효소(GALNT)라는 효소(20가지 유형)에 의해 수행된다.[6] 초기 ''O''-GalNAc 구조는 다른 당, 메틸기, 아세틸기 등의 화합물 첨가로 수정될 수 있으며,[3] 현재까지 8개의 코어 구조가 생성된다.[2] 세포마다 다른 글리코실전이효소를 가지므로 구조는 세포마다 다르다.[6] 일반적인 첨가 당은 갈락토스, N-아세틸글루코사민, 푸코스, 시알산이며, 황산기나 아세틸기로 수정될 수 있다.GalNAc는 전구체 분자의 세린, 트레오닌 잔기에 GalNAc 전이효소 작용으로 첨가된다.[3] 이 전구체는 당이 단백질에 첨가될 위치로 수송되는데 필수적이다. GalNAc 부착 특정 잔기는 정의되지 않았지만, 효소마다 선호 잔기가 다르다.[7] 트레오닌, 세린 근처에는 프롤린(Pro) 잔기가 자주 존재한다.[6]
초기 당 첨가 후, 다른 글리코실전이효소가 추가 당 첨가를 촉매한다. 가장 흔한 구조는 코어 1(초기 GalNAc에 갈락토스 첨가)과 코어 2(코어 1에 ''N''-아세틸글루코사민(GlcNAc) 추가)이다.[6] GlcNAc와 갈락토스 당을 번갈아 첨가하여 폴리-''N''-아세틸락토사민 구조를 형성할 수 있다.[6]
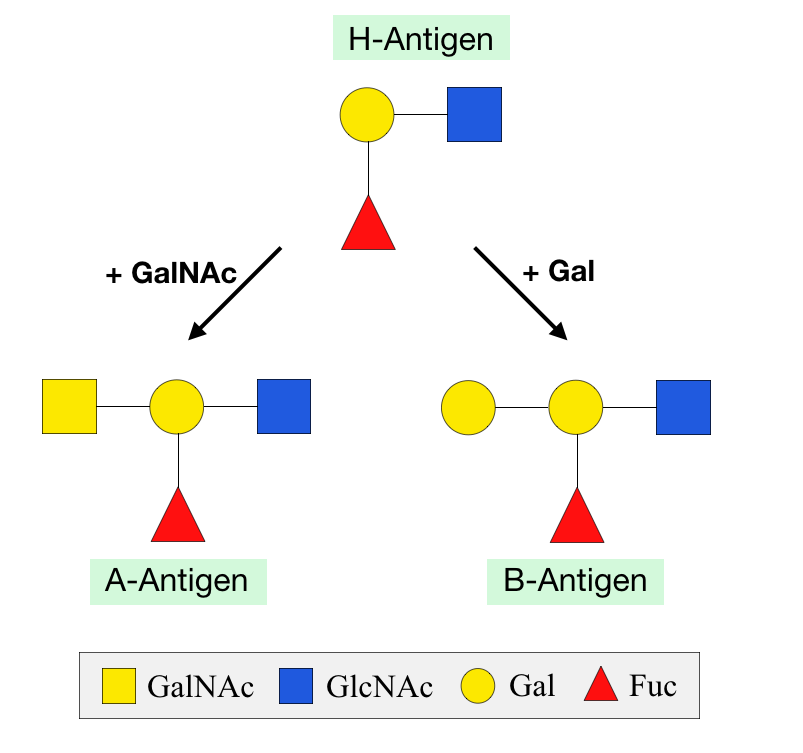
''O''-글리칸 말단 당은 렉틴 인식에 중요하며 면역계에서 핵심 역할을 한다. 푸코스 당 첨가는 루이스 에피토프와 ABO식 혈액형 결정인자 골격을 형성한다. 푸코스만 첨가하면 H 항원이 생성되며(O형),[6] 갈락토스 첨가는 B형 B 항원, GalNAc 당 첨가는 A형 A 항원을 생성한다.
2. 1. 2. 기능
''O''-GalNAc 당은 백혈구가 면역 반응 동안 순환하고, 수정 과정, 그리고 침입하는 미생물로부터 보호하는 것을 포함한 다양한 과정에서 중요한 역할을 한다.[3][2]''O''-GalNAc 당은 막 당단백질에서 흔히 발견되며, 막 근처의 영역의 강성을 증가시켜 단백질이 표면에서 멀리 뻗어 나가도록 돕는다.[6] 예를 들어, 저밀도 지단백질 수용체(LDL)는 O-글리칸에 의해 경직된 영역에 의해 세포 표면에서 돌출된다.[2]
면역 체계의 백혈구가 감염된 세포로 이동하기 위해서는, 수용체를 통해 이러한 세포와 상호 작용해야 한다. 백혈구는 이러한 상호 작용이 일어나도록 세포 표면에 리간드를 발현한다.[3] P-selectin glycoprotein ligand-1|P-셀렉틴 당단백질 리간드-1|PSGL-1영어은 그러한 리간드이며, 그 기능에 필요한 많은 O-글리칸을 포함한다. 막 근처의 O-글리칸은 PSGL-1이 연장된 구조를 유지하도록 돕고, 말단 sLex 에피토프는 수용체와의 상호 작용에 필요하다.[8]
뮤신은 위장관과 호흡기를 덮어 이 부위를 감염으로부터 보호하는, O-글리코실화가 많이 된 단백질 그룹이다.[6] 뮤신은 음전하를 띠고 있어 물과 상호 작용하여 증발을 막는다. 이것은 박테리아가 결합하여 신체를 감염시킬 수 없도록 관을 윤활하는 보호 기능을 한다. 뮤신의 변화는 암과 염증성 장 질환을 포함한 수많은 질병에서 중요하다. 뮤신 단백질에 O-글리칸이 없으면 3차원 구조가 극적으로 바뀌고, 종종 올바른 기능을 방해한다.[3][9]
2. 2. O-GlcNAc 글리코실화
''O''-GlcNAc 글리코실화는 N-아세틸글루코사민(GlcNAc)이 세린 또는 트레오닌 잔기에 결합하는 형태이다. 주로 세포질 및 핵 단백질에서 발견되며, 분비 단백질에서 주로 일어나는 ''O''-GalNAc 변형과는 다르다.[10] O-GlcNAc 변형은 비교적 최근에 발견되었지만, 이 변형을 겪는 단백질의 수는 빠르게 증가하고 있다.[7]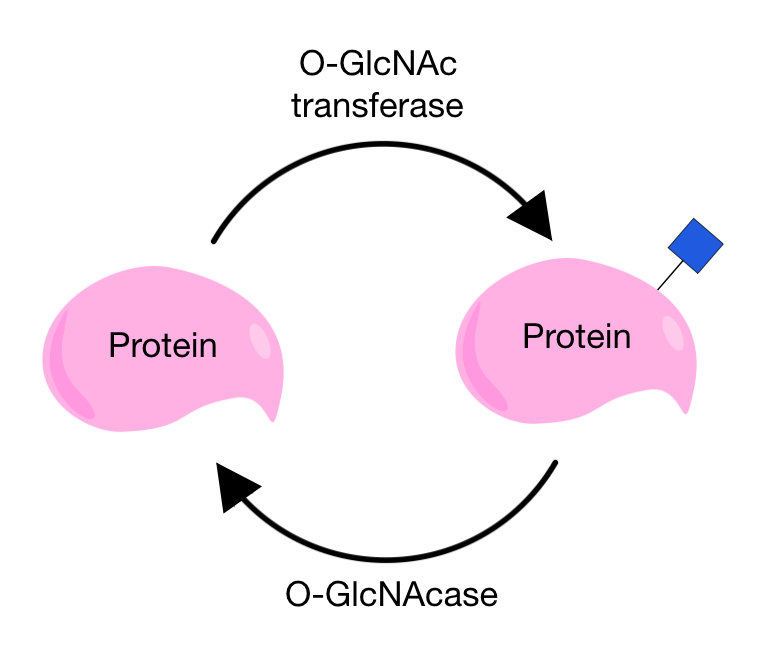
''O''-GlcNAc 글리코실화는 다른 O-글리코실화와 달리, 일반적으로 핵심 구조에 추가적인 당이 붙지 않고, 당이 단백질에 여러 번 부착되거나 제거될 수 있다는 특징이 있다.[6][7] 이러한 부착과 제거는 O-GlcNAc 전이 효소(OGT)와 O-GlcNAcase(OGA)라는 두 가지 특정한 효소에 의해 조절된다. O-GlcNAc는 OGT에 의해 추가되고, OGA에 의해 제거된다. 이 변형에 관여하는 효소가 두 가지뿐이므로, 조절이 매우 엄격하며 다른 여러 요인에 영향을 받는다.[11]
O-GlcNAc는 부착과 제거가 가능하므로 동적인 변형으로 알려져 있으며, 인산화와 유사한 점이 많다. O-GlcNAc 글리코실화와 인산화는 동일한 트레오닌 및 세린 잔기에서 발생할 수 있으며, 이는 세포의 여러 기능에 영향을 미치는 두 변형 간의 복잡한 관계를 시사한다.[6][12] 이 변형은 세포 스트레스 반응, 세포 주기, 단백질 안정성, 단백질 턴오버 등의 과정에 영향을 미친다. 파킨슨병, 후기 발병 알츠하이머병과 같은 신경 퇴행성 질환과 관련이 있을 수 있으며[3][13], 당뇨병에서도 역할을 하는 것으로 밝혀졌다.[14][13]
또한, O-GlcNAc 글리코실화는 바르부르크 효과를 증진시킬 수 있는데, 이는 암세포의 성장을 돕도록 변화하는 대사를 의미한다.[6][15] O-GlcNAc 글리코실화와 인산화는 모두 특정 잔기에 영향을 줄 수 있으므로, 신호 전달 경로를 조절하는 데 중요한 기능을 하며, 두 과정 모두 암 치료의 유망한 표적이 된다.
2. 3. O-만노스 글리코실화
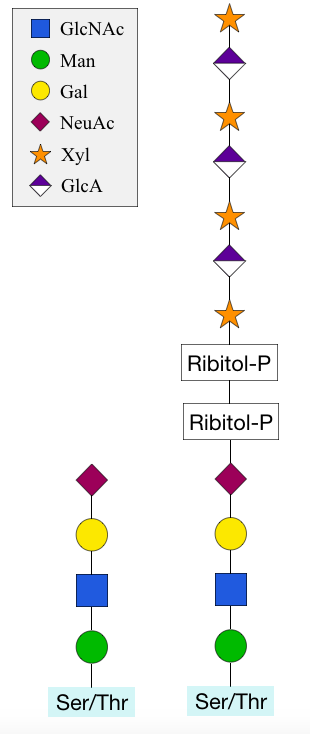
O-만노실화는 만노스가 돌리콜-''P''-만노스 공여 분자에서 단백질의 세린 또는 트레오닌 잔기로 전달되는 과정이다.[16] 다른 대부분의 O-글리코실화 과정은 당 뉴클레오티드를 공여 분자로 사용하며,[7] O-만노실화는 골지체 대신 세포의 소포체에서 시작된다는 차이점이 있다.[3] 그러나 추가적인 당의 첨가는 골지체에서 발생한다.[16]최근까지 이 과정은 균류에만 국한되는 것으로 생각되었지만, 진핵생물, (유)세균 및 고세균 등 모든 생명 영역에서 발생한다.[17] O-만노실화된 인간 단백질 중 가장 잘 알려진 것은 α-디스트로글리칸이다.[16] O-Man 당은 세포를 제 위치에 고정시키기 위해 세포 외 및 세포 내 영역을 연결하는 데 필요한 단백질의 두 도메인을 분리한다.[18] 리비톨, 자일로스 및 글루쿠론산은 긴 당 사슬을 형성하는 복잡한 변형으로 이 구조에 추가될 수 있다.[8] 이는 α-디스트로글리칸과 세포 외 기저막 사이의 상호 작용을 안정화하는 데 필요하다. 이러한 변형이 없으면 당단백질은 세포를 고정할 수 없어 심각한 뇌 기형을 특징으로 하는 선천성 근이영양증 (CMD)으로 이어진다.[16]
2. 4. O-갈락토스 글리코실화
콜라겐의 라이신 잔기는 수산기가 부착되어 하이드록시라이신이 형성되는 경우가 많다. 이 때문에 하이드록시라이신은 ''O''-글리코실화를 받을 수 있다. 갈락토스 부착은 소포체에서 시작되지만, 주로 골지체에서 특정 배열의 하이드록시라이신에 대해서만 진행된다.[3][19][45]이 ''O''-갈락토실화는 모든 콜라겐의 올바른 기능을 위해 필요하며, 특히 IV형과 V형에서 많이 발견된다.[20][46] 일부 경우 갈락토스 코어에 글루코스가 부착되기도 한다.[7][34]
2. 5. O-푸코스 글리코실화
푸코스 당을 세린 및 트레오닌 잔기에 첨가하는 것은 소포체에서 발생하며 두 개의 푸코실기전이효소에 의해 촉매되는 ''O''-글리코실화의 특이한 형태이다.[21] 이는 열대열원충(Plasmodium falciparum)[22]과 톡소포자충(Toxoplasma gondii)[23]에서 발견되었다.여러 효소가 핵심 푸코스의 신장을 촉매하며, 이는 단백질의 초기 푸코스에 다른 당을 첨가할 수 있음을 의미한다.[21] ''O''-글루코실화와 함께, ''O''-푸코실화는 주로 단백질에서 발견되는 상피세포 성장 인자(EGF) 도메인에서 발견된다.[7] EGF 도메인에서의 O-푸코실화는 단백질 서열의 두 번째와 세 번째 보존된 시스테인 잔기 사이에서 발생한다.[3] 핵심 O-푸코스가 첨가되면, 종종 GlcNAc, 갈락토스 및 시알산의 첨가에 의해 신장된다.
노치(Notch)는 발달에 중요한 단백질이며, O-푸코실화된 여러 EGF 도메인을 가지고 있다.[24] 핵심 푸코스의 정교함의 변화는 단백질이 형성할 수 있는 상호 작용을 결정하며, 따라서 발달 동안 어떤 유전자가 전사될지를 결정한다. O-푸코실화는 또한 간에서 단백질 분해에 역할을 할 수 있다.[3]
2. 6. O-글루코스 글리코실화
''O''-글루코실화는 소포체에서 O-글루코실전이효소에 의해 촉매되는 드문 ''O''-결합형 변형으로, 단백질에 부착되기 위해서는 특정 배열이 필요하다. ''O''-글루코스는 제VII인자나 제IX인자와 같이 EGF 도메인의 보존된 첫 번째 및 두 번째 시스테인 잔기 사이의 세린 잔기에 종종 부착된다.[34] ''O''-글루코실화는 노치 단백질 EGF의 올바른 폴딩에도 필요한 것으로 보인다.[51]3. 프로테오글리칸
프로테오글리칸은 세린과 트레오닌 잔기의 산소에 글리코사미노글리칸(GAG)이라는 하나 이상의 긴 당 사슬이 부착된 단백질이다.[26] GAG는 반복적인 당 단위로 구성된다. 프로테오글리칸은 일반적으로 세포 표면과 세포 외 기질에서 발견되며 연골과 힘줄의 강도와 유연성에 중요하다. 프로테오글리칸이 부족하면 심부전, 호흡 부전, 골격근 발달 결함, 종양의 전이 증가 등이 나타날 수 있다.
단백질 내 잔기의 산소 원자에 어떤 당이 연결되는지에 따라 다양한 유형의 프로테오글리칸이 존재한다. 예를 들어, 헤파란 황산의 GAG는 자일로스 당을 통해 단백질 세린 잔기에 부착된다.[7] 이 구조는 자일로스에 여러 개의 ''N''-아세틸락토사민 반복 당 단위가 추가되어 확장된다. 이 과정은 특이하며 Protein xylosyltransferase|자일로실트랜스퍼라제영어를 필요로 한다.[6] 케라탄 황산은 GalNAc을 통해 세린 또는 트레오닌 잔기에 부착되며, 두 개의 갈락토스 당과 글루쿠론산(GlcA) 및 GlcNAc의 반복 단위가 추가되어 확장된다. 제2형 케라탄 황산은 특히 연골에서 흔하다.[26]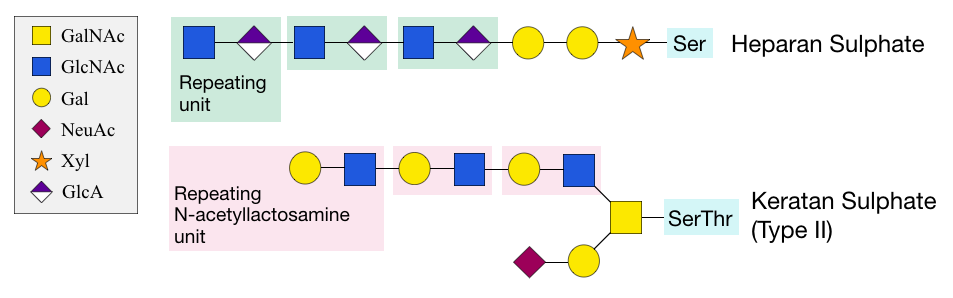
4. 지질의 O-글리코실화
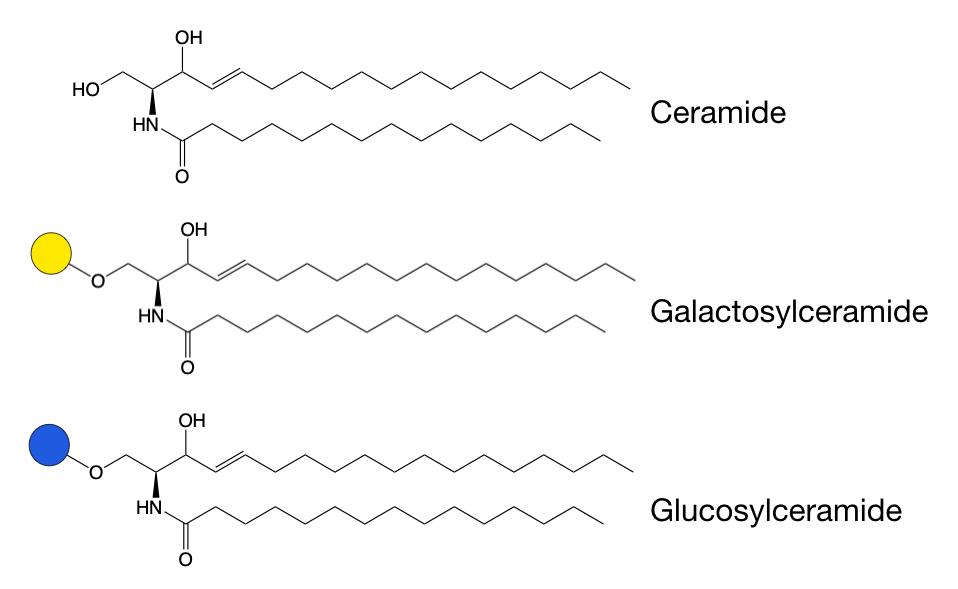
갈락토스 또는 글루코스 당은 세라마이드 지질의 하이드록실기에 부착될 수 있는데, 이는 단백질에서는 발생하지 않는 O-글리코실화의 한 형태이다.[6] 이로 인해 막에서 수용체의 국소화에 중요한 글리코스핑고지질이 형성된다.[8] 이러한 지질의 잘못된 분해는 종종 신경 퇴행 및 발달 장애를 특징으로 하는 스핑고지질증으로 알려진 질병 그룹으로 이어진다.
갈락토스와 글루코스 당 모두 세라마이드 지질에 첨가될 수 있기 때문에, 두 그룹의 글리코스핑고지질이 존재한다. 갈락토스핑고지질은 일반적으로 구조가 매우 단순하며, 핵심 갈락토스는 보통 변형되지 않는다. 그러나 글루코스핑고지질은 종종 변형되며 훨씬 더 복잡해질 수 있다.
갈락토- 및 글루코스핑고지질의 생합성은 다르게 일어난다.[6] 글루코스는 소포체에서 전구체로부터 세라마이드에 첨가된 후 골지체에서 추가적인 변형이 일어난다.[8] 반면, 갈락토스는 이미 골지체에 있는 세라마이드에 첨가되며, 여기서 형성된 갈락토스핑고지질은 종종 황산기 첨가에 의해 황산화된다.[6]
5. 글리코제닌
글리코제닌은 글리코겐 합성의 초기 단계에 관여하는 글리코실 전이 효소로, 티로신 잔기에 글루코스가 결합하는 특이한 ''O''-글리코실화 형태를 보인다.[7][34] 글리코제닌은 근육 및 간세포에 존재한다.[27][53]
6. 임상적 의의
O-결합 글리코실화는 신체 전체에 걸쳐 다양한 세포 기능에 중요한 역할을 한다.[3][28]
혈액형 결정에 중요한 루이스 항원은 이물질 감지 시 면역 반응을 유발하며, 장기 이식에서 이러한 항원에 대한 이해가 필수적이다.[3][28]
면역글로불린의 힌지 영역은 고도로 O-글리코실화되어 있어 구조를 유지하고 외부 항원과의 상호작용을 가능하게 하며, 단백질 분해 절단으로부터 보호한다.[3][8][28][35]
알츠하이머병에서 신경 변성을 일으키는 타우 단백질은 O-GlcNAc 변형을 포함하며, 이는 질병 진행과 관련될 수 있다.[3][28]
암에서는 O-글리코실화의 변화가 흔하게 나타나며, 특히 말단 루이스 항원을 포함한 O-글리칸 구조는 종양 세포의 전이에 중요하다.[6][33] 이러한 변화를 이해하면 암 진단 및 치료에 새로운 접근법을 제시할 수 있다.[3][28]
참조
[1]
논문
Concepts and principles of O-linked glycosylation
1998
[2]
논문
O-linked protein glycosylation structure and function
1996-02
[3]
논문
A general protein O-glycosylation system within the Burkholderia cepacia complex is involved in motility and virulence
2014-04
[4]
논문
Broad spectrum O-linked protein glycosylation in the human pathogen Neisseria gonorrhoeae
2009-03
[5]
논문
Identification of a general O-linked protein glycosylation system in Acinetobacter baumannii and its role in virulence and biofilm formation
2012
[6]
서적
Essentials of glycobiology
Cold Spring Harbor Laboratory Press
2015
[7]
논문
Protein glycosylation: nature, distribution, enzymatic formation, and disease implications of glycopeptide bonds
2002-04
[8]
서적
Introduction to Glycobiology
Oxford University Press Inc.
2011
[9]
서적
Essentials of Glycobiology
Cold Spring Harbor Laboratory Press
1999
[10]
논문
Protein O-GlcNAcylation: emerging mechanisms and functions
2017-07
[11]
논문
HCF-1 is cleaved in the active site of O-GlcNAc transferase
2013-12
[12]
논문
Cross talk between O-GlcNAcylation and phosphorylation: roles in signaling, transcription, and chronic disease
2011
[13]
논문
Opportunities for Therapeutic Modulation of O-GlcNAc
https://pubs.acs.org[...]
2024-11-07
[14]
논문
Protein O-GlcNAcylation in diabetes and diabetic complications
2013-08
[15]
논문
O-GlcNAcylation: The Sweet Side of the Cancer
2014
[16]
논문
Protein O-mannosylation: conserved from bacteria to humans
2009-08
[17]
논문
Protein O-mannosylation
1999-01
[18]
논문
Dystroglycan function requires xylosyl- and glucuronyltransferase activities of LARGE
2012-01
[19]
논문
Studies on the glycosylation of hydroxylysine residues during collagen biosynthesis and the subcellular localization of collagen galactosyltransferase and collagen glucosyltransferase in tendon and cartilage cells
1975-11
[20]
논문
A novel functional role of collagen glycosylation: interaction with the endocytic collagen receptor uparap/ENDO180
2011-09
[21]
논문
The O-linked fucose glycosylation pathway. Evidence for protein-specific elongation of o-linked fucose in Chinese hamster ovary cells
1997-07
[22]
논문
Protein O-fucosylation in Plasmodium falciparum ensures efficient infection of mosquito and vertebrate hosts
2017-09
[23]
논문
Toxoplasma gondii tachyzoite infection
2019-02
[24]
논문
Fringe benefits: functional and structural impacts of O-glycosylation on the extracellular domain of Notch receptors
2011-10
[25]
논문
Site-specific O-glucosylation of the epidermal growth factor-like (EGF) repeats of notch: efficiency of glycosylation is affected by proper folding and amino acid sequence of individual EGF repeats
2012-10
[26]
논문
Glycosaminoglycans and Proteoglycans
2018-02
[27]
서적
Human Biochemistry
Academic Press
2017
[28]
논문
Concepts and principles of O-linked glycosylation
1998
[29]
논문
O-linked protein glycosylation structure and function
1996-02
[30]
논문
A general protein O-glycosylation system within the Burkholderia cepacia complex is involved in motility and virulence
2014-04
[31]
논문
Broad spectrum O-linked protein glycosylation in the human pathogen Neisseria gonorrhoeae
2009-03
[32]
논문
Identification of a general O-linked protein glycosylation system in Acinetobacter baumannii and its role in virulence and biofilm formation
2012
[33]
서적
Essentials of glycobiology
Cold Spring Harbor Laboratory Press
2015
[34]
논문
Protein glycosylation: nature, distribution, enzymatic formation, and disease implications of glycopeptide bonds
2002-04
[35]
서적
Introduction to Glycobiology
Oxford University Press Inc.
2011
[36]
서적
Essentials of Glycobiology
Cold Spring Harbor Laboratory Press
1999
[37]
논문
Protein O-GlcNAcylation: emerging mechanisms and functions
2017-07
[38]
논문
HCF-1 is cleaved in the active site of O-GlcNAc transferase
2013-12
[39]
논문
Cross talk between O-GlcNAcylation and phosphorylation: roles in signaling, transcription, and chronic disease
2011
[40]
논문
Protein O-GlcNAcylation in diabetes and diabetic complications
2013-08
[41]
논문
O-GlcNAcylation: The Sweet Side of the Cancer
2014
[42]
논문
Protein O-mannosylation: conserved from bacteria to humans
2009-08
[43]
논문
Protein O-mannosylation
1999-01
[44]
논문
Dystroglycan function requires xylosyl- and glucuronyltransferase activities of LARGE
2012-01
[45]
논문
Studies on the glycosylation of hydroxylysine residues during collagen biosynthesis and the subcellular localization of collagen galactosyltransferase and collagen glucosyltransferase in tendon and cartilage cells
1975-11
[46]
논문
A novel functional role of collagen glycosylation: interaction with the endocytic collagen receptor uparap/ENDO180
2011-09
[47]
논문
The O-linked fucose glycosylation pathway. Evidence for protein-specific elongation of o-linked fucose in Chinese hamster ovary cells
1997-07
[48]
논문
Protein O-fucosylation in Plasmodium falciparum ensures efficient infection of mosquito and vertebrate hosts
2017-09
[49]
논문
Toxoplasma gondii tachyzoite infection
2019-02
[50]
논문
Fringe benefits: functional and structural impacts of O-glycosylation on the extracellular domain of Notch receptors
2011-10
[51]
논문
Site-specific O-glucosylation of the epidermal growth factor-like (EGF) repeats of notch: efficiency of glycosylation is affected by proper folding and amino acid sequence of individual EGF repeats
2012-10
[52]
논문
Glycosaminoglycans and Proteoglycans
2018-02
[53]
서적
Human Biochemistry
Academic Press
2017
[54]
논문
Concepts and principles of O-linked glycosylation
1998
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
